Amino Acids Reference Tool
Amino acids are organic compounds that contain mostly carbon, hydrogen, oxygen, and nitrogen atoms. They also have amine (–NH2) and carboxyl (–COOH) functional groups with side chains (R groups) that differentiate one amino acid from another. Sulfur and other additional elements can be found in some side chains.
Amino acids are the building blocks of proteins. They can be joined by peptide bonds to form polypeptide chains. Depending on the interactions of neighboring amino acids and their side chains, polypeptides fold and form three-dimensional molecules known as proteins. A protein’s shape and its amino acid components will help determine its function.
In addition to their essential role in protein formation, amino acids are important to biosynthesis, neurotransmitter transport, and other biochemical processes.
Amino Acid Categories
Approximately 500 amino acids exist, but only 20 appear in our genetic code. These 20 proteinogenic amino acids are known as standard amino acids.
An amino acid’s polarity is dependent on the structure of its side chains. The molecule will be more polar if the difference in electronegativity between atoms is greater. For example, alkane branches and benzene rings are considered non-polar, but alcohols and amines are polar.
Amino acids are classified by:
- Charge (positive vs. negative)
- pH (acidic vs. basic)
- Solubility (polar vs. non-polar)
- Core functional group location: alpha (α), beta (β), gamma (γ), or delta (δ)
- Side chain structure (aliphatic, aromatic, etc.)
Hydrophobicity
| Very Hydrophobic | Hydrophobic | Neutral | Hydrophilic |
|---|---|---|---|
| Phenylalanine | Tyrosine | Threonine | Arginine |
| Isoleucine | Cysteine | Histidine | Lysine |
| Tryptophan | Alanine | Glycine | Asparagine |
| Leucine | Serine | Glutamic Acid | |
| Valine | Glutamine | Proline | |
| Methionine | Aspartic Acid |
Based on values at pH 7.
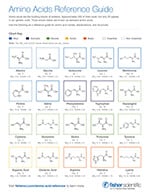
Amino Acids Reference Table
Amino Acid
Abbreviations
pKa, NH2
pKa, COOH
AlanineAla A9.872.35

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 89.09 |
| Classification | Alkyl |
Description: Alanine is a small, non-essential amino acid with a relatively non-reactive single methyl group side chain. It’s one of the simplest amino acids and the second most abundant in proteins. It’s encoded by codons that start with GC.
ArginineArg R9.092.18

| Side Chain Polarity | Polar |
| Charge | Positive |
| Molecular Weight (g/mol) | 174.20 |
| Classification | Basic |
Description: Arginine is a chemically complex amino acid with a 3-carbon aliphatic side chain ending in a guanidino group. It commonly mediates interactions between proteins and negatively charged DNA and RNA backbones.
AsparagineAsn N8.802.02

| Side Chain Polarity | Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 132.12 |
| Classification | Neutral |
Description: Asparagine is an amino acid with a carboxamide side chain. The amide group retains its polarity and is a rich hydrogen bond source, making asparagine a common protein binding site and substrate for glycosyltransferases.
Aspartic AcidAsp D9.601.88

| Side Chain Polarity | Polar |
| Charge | Negative |
| Molecular Weight (g/mol) | 133.10 |
| Classification | Acidic |
Description: Aspartic acid has a carboxylic acid side chain that reacts with other amino acids, enzymes, and proteins. Its negative charge and large hydrogen-bonding potential enables its participation in many molecular interactions.
CysteineCys C10.781.71

| Side Chain Polarity | Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 121.16 |
| Classification | Neutral |
Description: Cysteine is a semi-essential proteinogenic amino acid with a thiol side chain that participates in enzymatic reactions. Its sulfhydryl group forms disulfide bonds with other cysteines or molecules with free sulfhydryls.
Glutamic AcidGlu E9.672.19

| Side Chain Polarity | Polar |
| Charge | Negative |
| Molecular Weight (g/mol) | 147.13 |
| Classification | Acidic |
Description: Glutamic acid has one amino and two carboxyl groups that give it a negative charge in virtually all biological systems. This enables glutamic acid to interact with positively charged entities, including metal ions.
GlutamineGln Q9.132.17

| Side Chain Polarity | Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 146.15 |
| Classification | Neutral |
Description: Glutamine has a side chain similar to that of glutamic acid; one carboxyl group is simply replaced by an amide. It’s important for nitrogen metabolism and needed to help regulate toxic levels of ammonia in the body.
GlycineGly G9.602.34

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 75.07 |
| Classification | Alkyl |
Description: Glycine is the simplest amino acid with a single hydrogen atom for a side chain. This makes it ideal for accommodating the tight turns of some polypeptide chains. Glycine also acts as an inhibitory neurotransmitter.
HistidineHis H8.971.78

| Side Chain Polarity | Polar |
| Charge | Positive |
| Molecular Weight (g/mol) | 155.16 |
| Classification | Basic |
Description: Histidine is rare and has a partially protonated aromatic imidazole side chain. It may be neutral or positively charged and can serve as a natural catalyst or prevalent residue at enzyme active sites thanks to its bond potential.
IsoleucineIle I9.762.32

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 131.18 |
| Classification | Alkyl |
Description: Isoleucine has a branched hydrocarbon side chain arranged in an "L" shape and is considered one of the largest aliphatic amino acids. It’s concentrated in muscle tissue and encoded by the codons AUU, AUC, and AUA.
LeucineLeu L9.602.36

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 131.18 |
| Classification | Alkyl |
Description: Leucine has an isobutyl group side chain with four fully protonated carbons arranged in a bulky "Y" shape. It’s also the most common amino acid in proteins and one of the largest aliphatic amino acids.
LysineLys K10.288.90

| Side Chain Polarity | Polar |
| Charge | Positive |
| Molecular Weight (g/mol) | 146.19 |
| Classification | Basic |
Description: Lysine is an essential amino acid with a lysyl side chain. It’s important for proteinogenesis, crosslinking collagen polypeptides, absorbing mineral nutrients, and producing carnitine, key for fatty acid metabolism.
MethionineMet M9.212.28

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 149.21 |
| Classification | Alkyl |
Description: Methionine has a linear side chain and contains a sulfide group. This enables methionine to be a prolific methyl group donor. It also plays a critical role in metabolism, the growth of new blood vessels, and tissue repair.
PhenylalaninePhe F9.242.58

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 165.19 |
| Classification | Aromatic |
Description: Phenylalanine contains a benzyl group side chain and is considered the simplest and most abundant aromatic amino acid in proteins. It’s a precursor for tyrosine synthesis, dopamine, norepinephrine, epinephrine, and melanin.
ProlinePro P10.601.99

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 115.13 |
| Classification | Alkyl |
Description: Proline is a proteinogenic amino acid with a cyclic pyrrolidine side chain. It’s non-essential in humans and can be synthesized from glutamic acid. Essential to the immune system, proline is also key to joint and tendon function.
SerineSer S9.152.21

| Side Chain Polarity | Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 105.09 |
| Classification | Neutral |
Description: Serine is an amino acid with a hydroxymethyl group side chain. It’s the simplest hydroxyl amino acid and the third most abundant found in proteins. Serine can be synthesized from glycine and several other metabolites.
ThreonineThr T9.122.15

| Side Chain Polarity | Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 119.12 |
| Classification | Neutral |
Description: Threonine is an essential amino acid that contains a hydroxyl group, making it polar and uncharged. It shares many properties with serine and is a substrate to kinases and glycosyltransferases. It’s encoded by codons that start with AC.
TryptophanTrp W9.392.38

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 204.23 |
| Classification | Aromatic |
Description: Tryptophan is both the largest and rarest amino acid found in proteins. Generally found in the hydrophobic core of proteins, tryptophan is often involved in aromatic stacking. Its side chain is dominated by an indole group.
TyrosineTyr Y9.112.20

| Side Chain Polarity | Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 181.19 |
| Classification | Neutral |
Description: Tyrosine is an aromatic amino acid similar to phenylalanine with a hydroxyl group instead of a phenyl group in the para position. It has unique chemical properties and serves as a catalyst and substrate for a variety of kinases.
ValineVal V9.722.29

| Side Chain Polarity | Non-Polar |
| Charge | Neutral |
| Molecular Weight (g/mol) | 117.15 |
| Classification | Alkyl |
Description: Valine is a moderately sized aliphatic amino acid with a side chain consisting of a propyl group attached to the CA at C2. Like the other aliphatic residues, valine is often found in the hydrophobic cores of proteins.
Essential Amino Acids
The human body can produce 10 of the 20 required amino acids. The other half, called essential amino acids, come from your diet and must be consumed regularly.
| Produced by the Body (Non-Essential) | Supplied by Foods (Essential) | ||
|---|---|---|---|
| Alanine | Glutamine | Arginine** | Methionine |
| Asparagine | Glycine | Histidine | Phenylalanine |
| Aspartic Acid | Proline | Isoleucine | Threonine |
| Cysteine | Serine | Leucine | Tryptophan |
| Glutamic Acid | Tyrosine* | Lysine | Valine |
*Requires phenylalanine to produce
**Needed by children, but not adults
Additional Resources
A New Way to Shop for Chemicals
Conduct your search by drawing your molecule or uploading its chemical structure.

Access the Essentials
Print a copy of our amino acid reference sheet for your desk or keep a copy on your computer or phone.